Unsere Themen:
AbbVie hat sich zum Ziel gesetzt, neuartige Therapien für einige der komplexesten und schwerwiegendsten Krankheiten der Welt bereitzustellen und die medizinischen Herausforderungen von morgen anzugehen.
– Allergan
an AbbVie company
Aktuelle Fortbildungen für Urolog*innen.
CME-Module: Ganzjährig für Sie online!
Die Behandlung der idiopathischen überaktiven Blase mit BOTOX® wurde zum...
Mehr lesen...Zertifizierte Live-Webinare und Präsenzveranstaltungen
Die SgDU Servicegesellschaft der Deutschen Urologie mbH (Servicegesellschaft des Berufsverbandes...
Mehr lesen...Unsere Vision.

AbbVie ist ein globales, forschendes BioPharma-Unternehmen. AbbVie hat sich zum Ziel gesetzt, neuartige Therapien für einige der komplexesten und schwerwiegendsten Krankheiten der Welt bereitzustellen und die medizinischen Herausforderungen von morgen anzugehen.
AbbVie will einen echten Unterschied im Leben von Menschen machen und ist in verschiedenen wichtigen Therapiegebieten tätig:
Mehr erfahren ⟩
- Immunologie,
- Onkologie,
- Neurologie,
- Urologie,
- Augenheilkunde,
- Virologie und
- Frauenheilkunde sowie
- mit dem Portfolio von Allergan Aesthetics in der medizinischen Ästhetik.
In Deutschland ist AbbVie an seinem Hauptsitz in Wiesbaden und seinem Forschungs- und Produktionsstandort Ludwigshafen sowie mit Allergan in Frankfurt vertreten. Insgesamt beschäftigt AbbVie inklusive Allergan weltweit 45.000 und in Deutschland rund 2.800 Mitarbeiter*innen. Weitere Informationen zum Unternehmen finden Sie unter www.abbvie.com und www.abbvie.de. Folgen Sie @AbbVie auf Twitter.
〈 Weniger zeigen
BOTOX® von Allergan.
BOTOX® von Allergan: Alle Zulassungen in der Übersicht
BOTOX® ist der Markenname für Botulinumtoxin Typ A von Allergan für die therapeutische Anwendung. Es wurde 1993 erstmals in Deutschland zugelassen und ist somit heute bereits über 25 Jahre in Deutschland auf dem Markt!
Für die Anwendung im ästhetischen Bereich heißt Botulinumtoxin Typ A von Allergan: Vistabel®.
BOTOX® ist für eine Reihe von Indikationen zugelassen und in vielen Indikationen eine wertvolle Alternative!

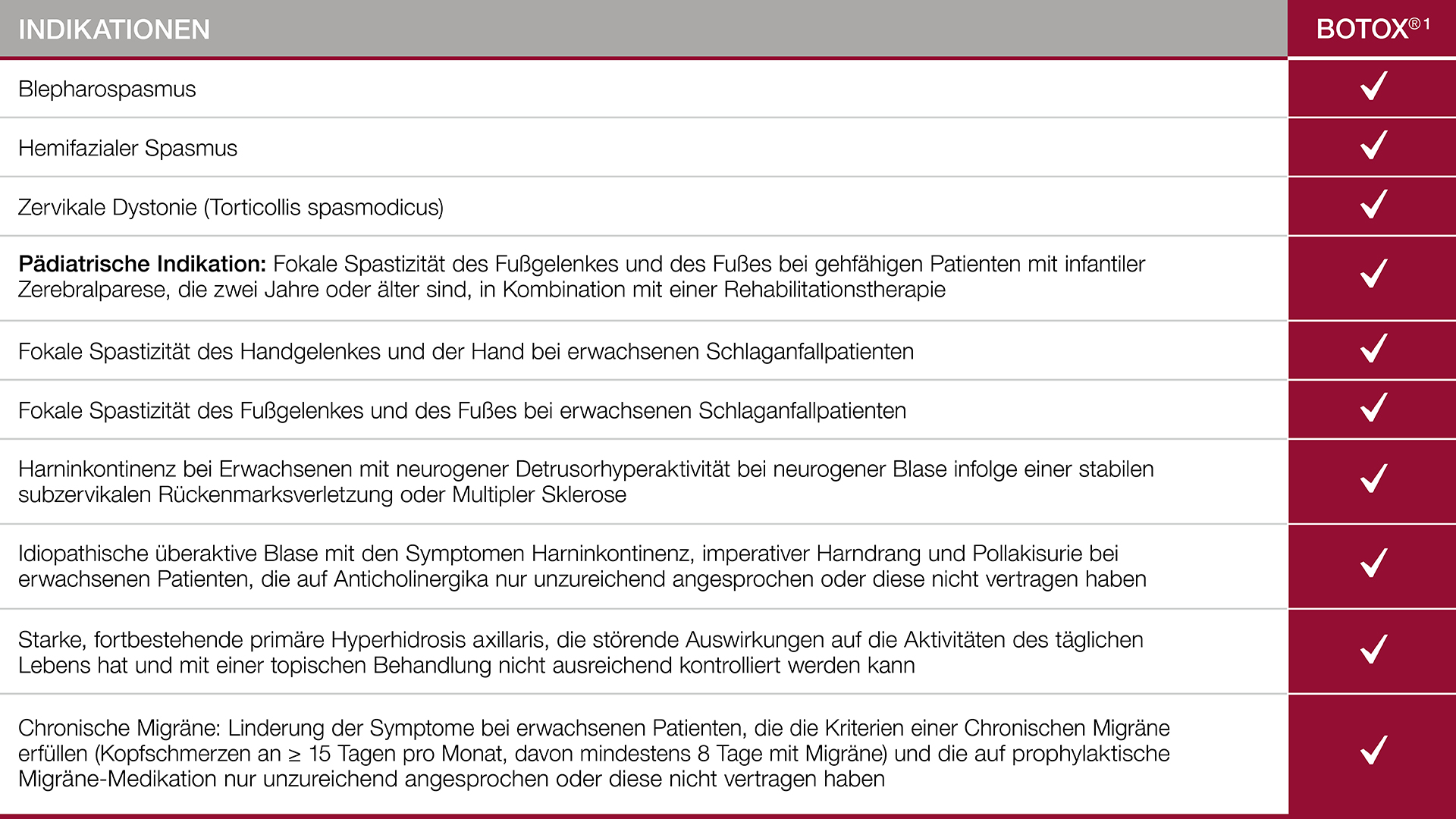
Bis 2018 gelang es Allergan, weitere Zulassungen in unterschiedlichen Indikationen für Botulinumtoxin Typ A zu erlangen. – 2013 erfolgte die Zulassung zur Behandlung der Idiopathischen überaktiven Blase.

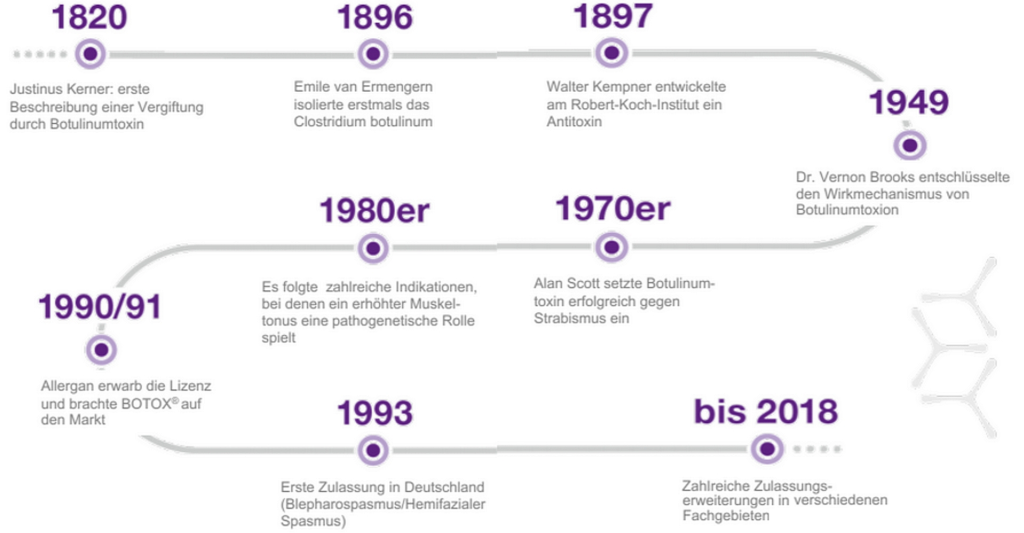
Botulinumtoxin A – eine kurze Reise durch die Geschichte.
Anfang des 19. Jahrhunderts beschrieb der Oberamtsarzt Justinus Kerner (1786-1862) als Erster das klinische Bild des Botulismus, der typischen Lebensmittelvergiftung. Rund 80 Jahre später gelang es Emile van Ermengern (1851-1932) das Bakterium Clostridium botulinum zu isolieren. Und erst in der Mitte des 20. Jahrhunderts gelang es, den Wirkmechanismus von Botulinumtoxin zu entschlüsseln.
Danach dauerte es weitere 30 Jahre, bis Botulinumtoxin Typ A das erste Mal therapeutisch eingesetzt wurde, und zwar zur Behandlung des Strabismus. Zu einem breiteren Einsatz kam es weitere 10 Jahre später im Bereich Blepharospasmus, hemifazialer Spasmus sowie bei komplexeren Dystonien, wie z. B. Torticollis spasmodicus.
BOTOX® von Allergan - auch in der Urologie.
Zulassungen bei Blasenfunktionsstörungen in der Urologie
BOTOX® von Allergan ist das einzige Botulinumtoxin Typ A, dass die folgenden Zulassungen bei Blasenfunktionsstörungen in der Urologie hat:

Idiopathische, überaktive Blase (iOAB)
Onabotulinumtoxin A (BOTOX®) ist das einzige Botulinumtoxin Typ A, das zur Therapie der idiopathischen überaktiven Blase mit den Symptomen Harninkontinenz, imperativer Harndrang und Pollakisurie bei erwachsenen Patienten zugelassen ist, die auf Anticholinergika nur unzureichend angesprochen oder diese nicht vertragen haben1.
Weiterlesen ⟩
Mindestens 16 % der erwachsenen Bevölkerung leiden nach aktueller Schätzung an einer idiopathischen überaktiven Blase („idiopatic overactive bladder“; iOAB).2 Doch nicht nur die Prävalenz der Erkrankung wird unterschätzt: Denn die Lebensqualität Betroffener ist häufig stark eingeschränkt. In der Folge ziehen sich Betroffene mehr und mehr aus dem sozialen Alltag zurück – dennoch spricht nur etwa ein Viertel der Patienten bestehende Symptome beim Arztbesuch an.3
Studien bestätigen Wirksamkeit
Zwei prospektive, randomisierte Studien (EMBARK-Studienprogramm) konnten eine signifikante Verbesserung aller untersuchten iOAB-Symptome und der Lebensqualität durch Onabotulinumtoxin A im Vergleich zu Placebo zeigen.4,5 Bereits 2 Wochen nach der Behandlung wurde eine signifikante Verbesserung der Symptome beobachtet. In Woche 12 nach Onabotulinumtoxin-A-Injektion war eine Verminderung der Harninkontinenz-episoden um 51 % gegenüber dem Ausgangswert zu beobachten (Verum: Ausgangswert 5,49, mittlere Änderung -2,80; verglichen mit 18 % unter Placebo: Ausgangswert 5,39, mittlere Änderung -0,95, p < 0,001). Auch die täglichen Harndrangepisoden hatten sich um 37 % gegenüber dem Ausgangswert reduziert (Verum: Ausgangswert 8,82, mittlere Änderung -3,30; verglichen mit 15 % unter Placebo, Ausgangswert 8,31, mittlere Änderung -1,23, p < 0,001)1. Darüber hinaus wurden zu diesem Zeitpunkt signifikant mehr klinisch bedeutsame Verbesserungen in allen Domänen des Inkontinenz-Lebensqualitäts-fragebogens erreicht (p < 0,001). Mehr als 60 % der Patienten im Verumarm beurteilten ihre Symptome als „deutlich verbessert“ oder „verbessert“ (p < 0,001 vs. Placebo).
Auch nach bis zu 6 Behandlungszyklen kann – so eine Langzeitstudie über 3 Jahre mit über 800 Patienten – mit konsistenten Therapieeffekten und einer verbesserten Lebensqualität gerechnet werden6. Insgesamt war Onabotulinumtoxin A in den Studien gut verträglich. Behandlungsabbrüche aufgrund von unerwünschten Ereignissen lagen bei unter 2 %. Systemische Nebenwirkungen traten unter der Therapie nicht auf. Die häufigsten unerwünschten Ereignisse waren Harnwegsinfekte und Dysurie1. Harnverhalt (≥ 200 ml) und eine dadurch erforderliche intermittierende Selbstkatheterisierung kam bei 6,5% der Patienten vor (im Vergleich zu 0,4% unter Placebo) und war meistens nur vorübergehend.4-6
Referenzen
- Fachinformation BOTOX®, Stand Dezember 2020
- www.urologenportal.de (letzter Zugriff im Januar 2021)
- Diokno AC et al. Fam Pract 2006; 23: 568– 577
- Nitti VW et al. J Urol 2016; 196: 791–800
- Nitti VW et al.J Urol 2013; 189:2186–2193
- Chapple C et al. Eur Urol 2013; 64: 249– 256
〈 Weniger zeigen
Neurogene Detrusorhyperaktivität (NDO)
Onabotulinumtoxin A (BOTOX®) ist das einzige Botulinumtoxin Typ A, das zur Behandlung einer Harninkontinenz bei Erwachsenen mit neurogener Detrusorhyperaktivität bei neuro-gener Blase infolge einer stabilen subzervikalen Rückenmarksverletzung oder Multipler Sklerose zugelassen ist1.
Weiterlesen ⟩
Die neurogene Detrusorhyperaktivität (NDO) ist definiert als Hyperaktivität des Detrusors aufgrund einer relevanten neurologischen Grunderkrankung.2,3 Hierzu gehören beispielsweise Rückenmarksverletzungen, eine Multiple Sklerose, ein Schlaganfall oder eine Parkinsonkrankheit.
Häufige Symptome sind: Pollakisurie, Nykturie, Drangsymptomatik und Harninkontinenz4.
Rückenmarksschädigung und NDO
Eine Rückenmarksverletzung (RMV) kann großen Einfluss auf die Speicher- und Aus-scheidungsfunktion der Blase haben. Sie kann zu einer Unter- oder Überaktivität der Blasenwand und der Sphinktere führen und dadurch zu einer Inkontinenz bis zum vollständigen Verlust der Fähigkeit zur Blasenentleerung. Die Form der Blasenfunktions-störung wird von der Höhe der RMV bestimmt. Je höher die RMV, desto ausgeprägter die resultierende Detrusorhyperaktivität.
Der Anteil der Patienten, die eine NDO entwickeln, ist abhängig von der Lokalisation und Schwere der Schädigung. Mehr als 98% der Patienten mit vollständiger Paraplegie und mehr als 99% mit Tetraplegie weise eine dauerhafte Dysfunktion der unteren Harnwege auf.5
Multiple Sklerose (MS) und NDO
MS wird meistens im Alter von 20 bis 40 Jahren disgnostiziert6. Bis zu 75% der MS-Patienten berichten über mindestens ein Symptom der Harninkontinenz, wie z. B. Pollakisurie. Häufig wird auch eine Drang- und Harninkontinenz beklagt7. Nach einer MS-Erkrankungsdauer von 10 Jahren haben mehr als zwei Drittel der Betroffenen begleitend Blasenfunktionsstörungen, wobei bei ca. 10% neurogene Blasenfunktionsstörungen wesentlicher Teil der Erst-symptomatik sind8.
Die Therapie neurogener Blasenstörungen verfolgt mehrere Ziele:
- Schutz des oberen Harntraktes und der Nierenfunktion
- Verbesserung der Kontinenz-Situation
- Verbesserung der Lebensqualität
- Wiederherstellung der Funktion des unteren Harntraktes.
Bei der Therapiewahl sind mögliche Nebenwirkungen und Komplikationen zu bedenken und die individuellen Besonderheiten und Bedürfnisse des Patienten.
Studien bestätigen Wirksamkeit
Im Rahmen des Studienprogramms wurde die Wirksamkeit und Sicherheit von BOTOX®-Injektionen bei 858 NDO-Patienten geprüft.9-12 Die Behandlung bewirkte eine signifikante Reduktion der Inkontinenzepisoden als primären Endpunkt13, wobei 37 % der Patienten in der Woche 6 zu 100 % kontinent waren13. Die gleichzeitige Anwendung von Anticholinergika hatte keinen Einfluss auf den Therapierfolg10.
Die Behandlung führte ferner zu einer signifikanten Zunahme der maximalen zytometrischen Kapazität sowie zu einer signifikanten Reduktion des maximalen Detrusordrucks im Vergleich zu Placebo13. Erzielt wurde zudem eine signifikante Verbesserung der Lebensqualität, wobei die Mehrheit der Patienten angab, mit der Therapie zufrieden zu sein14. Die Wirkung der Injektionen hielt im Mittel 256 bis 295 Tage an1. Die Therapieabbruchrate war mit unter 3% aufgrund unerwünschter Ereignisse (UAE) sehr niedrig13. Auch bei wiederholter Anwendung traten nicht vermehrt UAE auf13.
Aufnahme in die Leitlinie
Die intravesikale Injektion von BOTOX in den Detrusor versicae hat sich als Therapie der medikamentenrefraktären neurogenen Detrusorhyperaktivität fest etabliert. Das minimal-invasive Verfahren verbessert die urodynamischen und subjektiven Parameter sowie die Lebensqualität der Betroffenen deutlich. Es schließt die Lücke zwischen der medikamentösen und der offenen operativen Therapie. Daher empfiehlt die Deutsche Gesellschaft für Neurologie in ihrer „Leitlinie zur Diagnostik und Therapie von neurogenen Blasenstörungen diese Therapieoption16.
Referenzen
- Fachinformation BOTOX®, Stand Dezember 2020
- Neurogene Blasenentleerungsstörung aus MSD Manuals, https://www.msdmanuals.com/de-de/profi/urogenitaltrakt/miktionsstörungen/neurogene-blasenentleerungsstörung, letzter Zugriff im Januar 2021
- Abrams P et al. Neurourol Urodynamics 2010; 29: 213-240
- DGN Leitlinie: Diagnostik und Therapie von neurogenen Blasenstörungen, https://dgn.org/leitlinien_tags/diagnostik-und-therapie-von-neurogenen-blasenstoerungen/, letzter Zugriff im Januar 2021
- McKinley WO et al. Arch Phys Med Rehabil. 1999;80(11):1402-1410
- https://www.msif.org/about-ms/what-is-ms;
- Mahajan ST et al. J Urol. 2010;183(4):1432-7143
- Multiple Sklerose & Blasenfunktionsstörung aus: TRIAS Verlag Gesundheit – Gesund leben, https://www.thieme.de/de/gesundheit/blasenfunktionsstoerung.htm, letzter Zugriff im Januar 2021
- Schurch B et al. J Urol. 2005;174(1):196-200
- Ginsberg D et al. J Urol. 2012;187(6):2131-2139
- Cruz F et al. Eur Urol. 2011;60(4):742-750/li>
- Kennelly M et al. Urology. 2013;81(3):491-497
- Rovner E et al. Neurourol Urodyn. 2013;32(8):1109-1115
- Chancellor MB et al. Neurology. 2013;81(9):841-848
- Leitlinien „Diagnostik und Therapie von neurogenen Blasenstörungen“, AWMF 030/121 (2020)
〈 Weniger zeigen
Unser Engagement.
Der ethischen Verantwortung bewusst.
Info-Seiten für Patient*innen.
Transparenz & Partnerschaften.

Partner-Kontakt.
Anschrift
Allergan GmbH
Stichlingstraße 1
60327 Frankfurt am Main
Bürozeiten:
Mo. – Fr. 9:00 – 17:00 Uhr
Medizinische Anfragen, UAW-Meldung, Produktbeanstandungen
Kontakt innerhalb der Geschäftszeiten:
Nebenwirkungsmeldungen
Telefon: 0611 1720 1520
Fax: 069 50603822
E-Mail: et-pharmacovigilance@allergan.com
Produkt oder Qualitätsmängel
Telefon: 069 9203810
Fax: 069 50603825
E-Mail: et-qa@allergan.com
Medizinisch-Wissenschaftliche Anfragen
Telefon: 0611 1720 1520
E-Mail: medinfo.germany@abbvie.com
Notfall-Kontakt außerhalb der Geschäftszeiten (24 Stunden Dienst)
Telefon: 0611 1720 1520